LECCIÓN 4.3
Reacciones ácido-base
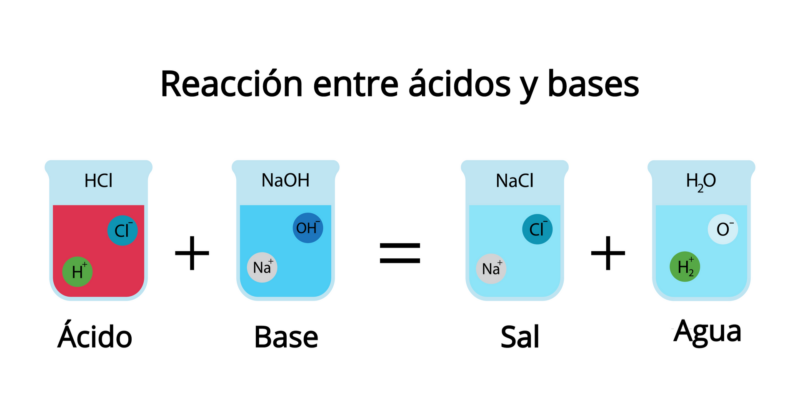
Las reacciones ácido-base son un tipo fundamental de reacción química que ocurre entre un ácido y una base. Estas reacciones son esenciales para comprender diversos procesos químicos Naturales e industriales y tienen gran importancia en la vida cotidiana, la medicina, la agricultura y el medio ambiente.
Un ácido, según la definición clásica de Arrhenius, es una sustancia que libera iones hidrógeno (H⁺) en solución acuosa, mientras que una base libera iones hidroxilo (OH⁻). Por ejemplo, el ácido clorhídrico (HCl) al disolverse en agua libera iones H⁺, y el hidróxido de sodio (NaOH) libera iones OH⁻. Cuando estas dos sustancias reaccionan, se neutralizan mutuamente formando agua (H2O) y una sal, en un proceso llamado neutralización:
Más modernas definiciones incluyen a Brønsted-Lowry, que define ácidos como donadores de protones (H⁺) y bases como aceptores de protones. Esto amplía las reacciones ácido-base a procesos que no necesariamente ocurren en solución acuosa.
La teoría de Lewis amplía aún más el concepto, considerando ácido a una sustancia capaz de aceptar un par de electrones y base a quien pueda donar ese par. Esta teoría explica reacciones ácido-base en medios no acuosos o más complejos.
Además de la reacción de neutralización, las reacciones ácido-base pueden implicar transferencia de protones entre pares ácido-base conjugados, donde un ácido cede un protón y se transforma en su base conjugada, y una base acepta ese protón produciendo su ácido conjugado.
Estas reacciones son fundamentales para mantener el equilibrio del pH en sistemas biológicos y ambientales y se utilizan en la industria para procesos de limpieza, fabricación de farmacéuticos, alimentos y control de calidad del agua.
Conocer las propiedades y comportamientos de ácidos y bases permite aplicar técnicas analíticas y prácticas experimentales para identificar sustancias, controlar procesos y garantizar la seguridad en distintas aplicaciones.