LECCIÓN 4.3
Fuerzas Intermoleculares
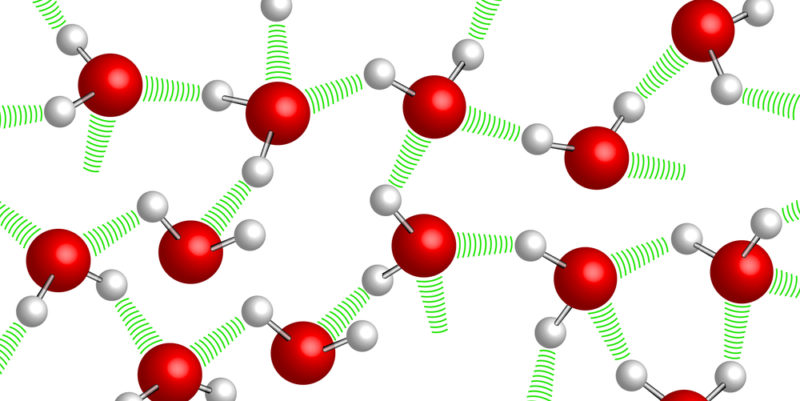
Las fuerzas intermoleculares son las interacciones que ocurren entre moléculas y que determinan muchas de las propiedades físicas de las sustancias, tales como el punto de fusión, el punto de ebullición, la solubilidad, la viscosidad y la tensión superficial. A diferencia de los enlaces intramoleculares, que mantienen unidos a los átomos dentro de una molécula (como los enlaces covalentes o iónicos), las fuerzas intermoleculares son generalmente mucho más débiles, pero su efecto acumulativo es fundamental para el comportamiento de la materia en diferentes estados.
Existen principalmente tres tipos de fuerzas intermoleculares: las fuerzas de Van der Waals, que incluyen las fuerzas de dispersión de London y las fuerzas dipolo-dipolo; y los puentes de hidrógeno, que son una forma especial y más intensa de interacción dipolo-dipolo.
Las fuerzas de dispersión de London se producen entre todas las moléculas, sean polares o no polares, y surgen debido a fluctuaciones temporales en la distribución de electrones que inducen dipolos instantáneos en las moléculas. Son fuerzas débiles pero universales.
Las fuerzas dipolo-dipolo ocurren entre moléculas polares con dipolos permanentes, donde el polo positivo de una molécula atrae el polo negativo de otra.
Los puentes de hidrógeno son interacciones fuertes que ocurren cuando un átomo de hidrógeno enlazado covalentemente a un átomo muy electronegativo (como oxígeno, nitrógeno o flúor) es atraído por otro átomo electronegativo en una molécula vecina. Esta fuerza es crucial en diversas sustancias, como el agua, donde explica sus peculiares propiedades.
La intensidad creciente de estas fuerzas se refleja en el aumento de los puntos de ebullición y fusión: sustancias con puentes de hidrógeno tienen generalmente puntos de ebullición más altos que aquellas sin ellos.
Entender las fuerzas intermoleculares permite explicar y predecir comportamientos físicos y químicos, tanto en contextos naturales como tecnológicos, y es base para el estudio avanzado de la química y la física de materiales.